Лужні елементи - лужні метали
За матеріалами
з Вікіпедії — вільної енциклопедії.| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Uuh | Uus | Uuo | |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
| Група 1 періодичної таблиці (Лужні метали) |
Лу́жні мета́ли — елементи групи 1 періодичної системи, за старою класифікацією головної підгрупи I групи. Назва пов'язана з тим, що при взаємодії лужних металів з водою утворюється їдкий луг. До лужних металів належать (у порядку збільшення атомного номера) літій (Li), натрій(Na), калій (K), рубідій (Rb), цезій (Cs) , францій (Fr).
Загальна характеристика
Характерною рисою будови атомів лужних металів, є наявність одного електрона на зовнішній електронній оболонці. Завдяки цьому всі вони з легкістю віддають електрон, отримуючи при цьому завершений (попередній) енергетичний рівень. В реакціях лужні метали виступають сильними відновниками.
Хоча лужні метали надзвичайно поширені на Землі, у природі вони існують винятково у вигляді сполук через високу відновлювальну активність. Na, K відкриті в 1807 Гемфрі Деві, який першим почав широко застосовувати електроліз. Li відкрив Йоганн Арфведсон (Швеція, 1817), Rb — Роберт Бунзен, Густав Кірхгофф (Німеччина, 1861), Cs — Роберт Бунзен, Густав Кірхгофф (Німеччина, 1860), Fr — Маргерітт Пере (Франція, 1939).
Фізичні властивості лужних металів
Лужні метали — м'які (натрій ріжеться ножем, як вершкове масло, інші трохи жорсткіші) метали від сріблясто-білого до сірого кольору з характерним блиском, які дуже швидко тьмяніють на повітрі. Легкоплавкі й рухливі. Агресивні, вибухонебезпечні (зберігаються в атмосфері інертного газу або під шаром гасу). У розплавленому стані здатні проводити струм. Цезій можна розплавити темлом людської долоні (потримавши ампулу з цезієм в долоні).
Лужні метали зберігають в закритих посудинах під шаром гасу або в запаяних ампулах ( для запобігання контакту з речовинами навколишнього середовища).

Різання натрію ножем

Реакція натрію з киснем (а), зберігання натрію під шаром гасу (б), горіння натрію в сірці (в)
Хімічні властивості
Лужні метали легко реагують із киснем.
 (літій оксид)
(літій оксид) (натрій пероксид)
(натрій пероксид)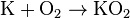 (калій надпероксид)
(калій надпероксид)
Легко реагують із водою, з виділенням великої кількості тепла:
Взаємодіють із неметалами:
Всі сполуки лужних елементів з Оксигеном мають різне забарвлення, інтенсивність якого посилюється в ряді від Li до Cs:
| Формула кисневої сполуки | Колір |
|---|---|
| Li2O | Білий |
| Na2O | Білий |
| K2O | Світло - жовтий |
| Rb2O | Жовтий |
| Cs2O | Оранжевий |
| Na2O2 | Світло-жовтий |
| KO2 | Оранжевий |
| RbO2 | Темно-коричневий |
| CsO2 | Жовтий |
Взаємодія з кислотами.
Натрій і калій здатні витискувати водень не лише з води, а й із розбавлених кислот — слабких окисників (НСІ, CH3COOH, H2SO4, H2S, HBr):

Реакції лужних металів з кислотами — сильними окисниками перебігають бурхливо, іноді з вибухом:

Взаємодія з оксидами металічних елементів. Натрій як сильний відновник витісняє деякі металічні елементи з їх оксидів за високих температур, наприклад:

Взаємодія з органічними сполуками. Натрій та калій реагують з деякими органічними сполуками, наприклад спиртами, з яких натрій та калій витискують водень:



Галерея
Застосування лужних металів та їх сполук:
Застосування лужних металів зумовлене їх фізико-хімічними властивостями. Так, натрій легко взаємодіє з киснем повітря, тому його використовують для видалення бульбашок газу зі сплавів металів. У складі сплавів він надає їм здатності стискуватися і при цьому не розтріскуватися, зберігати твердість. З них виробляють осьові підшипники для залізничного транспорту, оскільки вони працюють в умовах постійної та різкої зміни навантажень. Натрій, іноді разом з калієм, застосовується в кольоровій металургії як відновник для добування важких металів; у ядерних реакторах — як теплоносій; при добуванні синтетичного каучуку — як каталізатор; є осушувачем органічних речовин.
Високу хімічну активність літію використовують для виготовлення радіоламп. Для створення вакууму в колбу вносять невеличкий шматочок літію, який миттєво поглинає залишки повітря.
Властивість рубідію та цезію реагувати на світло застосовується у фотоелементах: при освітленні їх поверхні вони стають джерелом електричного струму, при зникненні освітлення струм так само зникає. Фотоелементи широко використовуються в звуковому кіно, на телебаченні. Найкращі фотоелементи виробляють зі сплаву стибію та цезію.
Існують проекти використання францію для ранньої діагностики раку: встановлено, що він накопичується в ракових пухлинах.
Металічний натрій – найширше застосований метал. Він використовується у металургії як відновник, для абсолютування органічних розчинників, як теплоносій в ядерних реакторах разом з калієм, для добування Na2O2, який, у свою чергу, застосовується для очищення та регенерації повітря в апаратах штучного дихання.
Сполуки натрію використовуються у медицині і багатьох галузях промисловості. Пероксиди застосувують для вибілювання тканин, гідроксид натрію – при виробництві целюлози, виготовленні мил і миючих засобів, штучного волокна, очищення мастил, виробництві барвників тощо. Фторид натрію використовують для просочення деревини і як флюс.
Металічний калій застосовують рідше, ніж натрій. Його використовують у металотермії та органічних синтезах для одержання сплавів з натрієм та іншими металами, а також для вимірювання поглинання рентгенівського випромінювання за допомогою калієвої пластинки. З нього одержують надпероксид, який використовують у підводних човнах для регенерації повітря:
4КО2 + 2CO2 à 2K2CO3 + 3O2
Сполуки калію застосовують у сільському господарстві як добрива, в стекольній промисловості, при виробництві рідкого мила та ін.
Рубідій та цезій застосовують для виготовлення фотоелементів. Інтерметалеві сполуки рубідію та цезію Rb3Sb і Cs3Sb використовують як напівпровідниковий матеріал при виготовленні фотокатодів. Багато комплексних сполук, що містять Rb і Cs, використовують в аналітичній хімії.
Література
- Ахметов Н. С. Загальна та неорганічна хімія. — М.: Вища школа, 2001. — ISBN 5-06-003363-5.
- Лідин Р. А.. Довідник із загальної та неорганічної хімії. — М.: колоси, 2008. — ISBN 978-5-9532-0465-1.
- Некрасов Б. В. Основи загальної хімії. — М.: Лань, 2004. — ISBN 5-8114-0501-4.
- Спіцин В. І., Мартиненко Л. І. Неорганічна хімія. — М.: МДУ, 1991, 1994.
- Турова Н. Я. Неорганічна хімія в таблицях. Навчальний посібник. — М.: ЧеРо, 2002. — ISBN 5-88711-168-2.
- Greenwood, Norman N.; Earnshaw, Alan. (1997), Chemistry of the Elements (2nd ed.), Oxford:Butterworth-Heinemann, ISBN 0-08-037941-9
- F. Albert Cotton, Carlos A. Murillo, and Manfred Bochmann, (1999), Advanced inorganic chemistry. (6th ed.), New York:Wiley-Interscience, ISBN 0-471-19957-5
- Housecroft, C. E. Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall, ISBN 978-0-13-175553-6







Немає коментарів:
Дописати коментар